Príprava cez diazozlúčeninu
Metódy v tejto skupine sú oveľa menej početné, ale vyznačujú sa vysokými výťažkami, nízkymi hladinami nečistôt vedľajších produktov, jednoduchosťou a rozmanitosťou prevedenia.
Najjednoduchšou a najspoľahlivejšou metódou tejto skupiny je uskutočnenie Sandmeyerovej reakcie. Existujú 2 príklady rôzne aktivity len táto etapa:

2.3 Iné metódy

PhBr + TfOMe, kyselina antranilová v Borodin-Hunsdieckerovej reakcii, reakcia o-dibrómbenzénu a MeMgBr atď. - majú výhody oproti iným metódam a majú nižšiu preparatívnu hodnotu, hoci sú zaujímavé.
Vybraná cesta syntézy - analýza, popis metód vykonávania experimentálnych etáp
Hlavným kritériom pre výber jednej alebo druhej metódy, ktorá je podrobne opísaná vyššie, je spoľahlivosť a dostupnosť. Tomu zodpovedá cesta toluén – nitrotoluén – o-toluidín – o-brómtoluén.
Nitrácia toluénu
0,15 mol aromatickej nitrozlúčeniny sa umiestni do 250 ml trojhrdlovej banky vybavenej miešadlom, prikvapkávacím lievikom a vnútorným teplomerom (zariadenie by nemalo byť utesnené). Potom pomaly pridávajte nitračnú zmes, vopred ochladenú na aspoň 10 °C, za dobrého miešania a chladiaceho ľadového kúpeľa, teplota reakčnej zmesi by mala byť v rozmedzí 5-10 °C.
Potom miešajte pri izbovej teplote ďalšie 2-3 hodiny. Potom sa reakčná zmes opatrne naleje do 300 ml ľadová voda a dobre premiešame. Organická vrstva sa oddelí a vodná vrstva sa extrahuje éterom. Spojené organické extrakty sa premyjú vodou, 2N. roztokom hydrogénuhličitanu sodného do neutrálnej reakcie, potom opäť vodou. ohrievač. Extrakty sa sušia nad CaCl2 a destilujú. P-izomér sa zmrazí zmesou ľadu a soli a premyje malým množstvom studeného petroléteru. (Stačí opatrná separácia; pri tejto metóde sa získajú asi 4 % p-izoméru: zmraziť na 8 hodín so zmesou ľadu a soli (2:1). Dobrá cesta separácia je redukcia p-izoméru alkalickým redukčným činidlom. P-toluidín je možné separovať vďaka svojim základným vlastnostiam. Separácia sa najlepšie dosiahne frakčnou destiláciou, po ktorej nasleduje kryštalizácia 11). Z filtrátu vákuovou destiláciou na 30 cm kolóne Vigre s elektrické kúrenie o-izomér sa izoluje. Výťažok o-izoméru je 40 %. Teploty varu o- a p-nitrotoluénu sú 96 °C/9 mm. a 105 °C/10 mm, teplota topenia p-toluidínu 52-54 °C.
1 .. 40 > .. >> Ďalej
Nečistené TNT je možné použiť len na výrobu výbušných zmesí určených na rýchle použitie, napríklad na trhacie práce. TNT používaný na vybavenie munície, ktorá je predmetom dlhodobého skladovania, musí byť podrobená čisteniu.
TECHNOLÓGIA NA ZÍSKANIE TNT
Zákonitosti nitračného procesu
Nitrácia toluénu na mononitrotoluén. Keď sa toluén nitruje na mononitrotoluén, získajú sa tri izoméry: orto-, para- a meta, pričom prevláda orto-mér. Meta-izomér sa tvorí v relatívne malom množstve, ale keďže jeho ďalšou nitráciou vznikajú nesymetrické trinitrotoluény, jeho tvorba je nežiaduca.
Hlavná práca na štúdiu zákonitostí reakcie nitrácie toluénu na mononitrotoluén bola zameraná najmä na identifikáciu podmienok pre najnižší výťažok let izoméru. Keď sa stali dominantnými kontinuálne nitračné procesy a vyvstala otázka racionálnych návrhov nitrátorov, začalo sa štúdium kinetiky nitrácie, najmä v hetero-
Ryža. 17. Rozpustnosť toluénu v kyseline sírovej rôznych koncentrácií pri 55 °C.
65 70 75 80 85 90 Koncentrácia HzS047%
95
génového prostredia, ktoré zodpovedá priemyselným podmienkam. Súčasne sa študovala rozpustnosť toluénu v zmesiach kyseliny sírovej a dusičnej, distribúcia zložiek medzi vrstvami, vplyv miešania a pomer objemov organických a kyslých vrstiev na rýchlosť reakcie. Rozpustnosť toluénu v kyseline sírovej sa zvyšuje so zvyšujúcou sa koncentráciou kyseliny; do koncentrácie kyseliny 80% je rozpustnosť toluénu veľmi nízka (obr. 17).
Rýchlosť nitrácie toluénu za heterogénnych podmienok výrazne závisí od intenzity miešania a modulu kúpeľa (pomer objemov minerálnej a organickej vrstvy) (obr. 18).
Distribučný koeficient kyseliny dusičnej medzi vrstvami toluénu a kyseliny sírovej je 0,066. To naznačuje, že kyselina dusičná pri heterogénnej nitrácii toluénu prechádza do organickej vrstvy len v malom rozsahu, a preto je podiel reakcie, ktorá tam prebieha, prakticky nulový.
Nízka rozpustnosť toluénu v kyseline sírovej strednej koncentrácie, absencia prechodu kyseliny dusičnej do organickej vrstvy, ako aj prudká závislosť rýchlosti reakcie nitrácie toluénu od intenzity miešania a objemový zlomok minerálna vrstva naznačuje, že nitračná reakcia toluénu za heterogénnych podmienok prebieha na rozhraní medzi vrstvami. Rýchlosť reakcie v tomto prípade závisí od koncentrácie reagujúcich zložiek na tomto povrchu, ktorá je zase určená rýchlosťou difúzie reagujúcich zložiek z hĺbky vrstvy na rozhranie a rýchlosťou odchodu reakcie. výrobky z nej. To všetko, ako aj stav reagujúcich zložiek, závisí od teploty (obr. 19, c), koncentrácie kyslej zmesi (obr. 19, b) a intenzity miešania (obr. 18), resp. rýchlosť nitrácie toluénu v heterogénnych podmienkach je nižšia ako v homogénnych podmienkach (obr. 19.6).
Tvorba 5-6% l-nitrotoluénu počas nitrácie toluénu ďalej vedie k tvorbe 5-6% nesymetrických trinitrotoluénov, ktoré kontaminujú TNT. Teplota tuhnutia
Ryža. 18. Vplyv intenzity miešania (a) a modulu yanna (6") na stupeň nitrácie toluénu.
Koncentrácia TNT obsahujúceho asymetrické izoméry klesá podľa nasledujúcej závislosti:
Г3 = (80,80 – 0,465С)
kde C je obsah l-nitrotoluénu v pôvodnom mononitrotoluéne, %.
Izomérne zloženie mononitrotoluénu je výrazne ovplyvnené teplotou nitrácie toluénu (pozri str. 85). Štúdium rýchlosti nitrácie toluénu pri 0 a 30 °C a stanovenie izomérneho zloženia umožnilo vypočítať v Arrheniovej rovnici (pozri str. 54) koeficient B pre vstup nitroskupiny do rôznych polôh relatívneho na skupinu CH3: B0 = 2,90 V, Bp = 2, 70 Vm\ aktivačná energia pre zodpovedajúce polohy sa rovná: E„ - E0 = 3,83 kJ/(mol-°C), E„ - ?„ = 4,61 kJ /(mol-°C). Z týchto údajov sa dá formulovať ďalšie pravidlo„Pokles nitračnej teploty pomáha zvyšovať výťažnosť p-nitrotoluénu a znižovať výťažnosť o- a m-nitrotoluénov.
Nitračná aktivita kyslej zmesi má významný vplyv na výťažok l-nitrotoluénu. Zvýšenie F zo 68 na 82 % počas nitrácie toluénu zmesami síry a kyseliny dusíka pri 55 °C znižuje výťažok let-izoméru 2,4 krát. Na obr. Obrázok 20 ukazuje vplyv teploty a faktora nitračnej aktivity kyslej zmesi na výťažok 1-nitrotoluénu.
Použitie zriedenej kyseliny dusičnej (70 %) na nitráciu toluénu vedie k tvorbe produktov oxidácie, najmä kyseliny benzoovej. Použitie ešte zriedenejšej kyseliny (32%) pri zvýšenej teplote (105°C) spôsobuje nitráciu bočného reťazca, vzniká fenyl-nitrometán, ktorý sa získava aj nitráciou toluénu oxidom dusičitým.
-l-I-a,; ,„i, I_I I-1_¦ \ ¦_I
25 zo 40 60 č. 70 v 64 jej ju ju 72 74
Tvmperashura, °С F
Ryža. 19. Závislosť rýchlosti nitrácie toluénu od teploty (a) a faktora nitračnej aktivity F (6*):
Nitrácia
Nitračná reakcia je jednou z najviac študovaných aromatických substitučných reakcií. Na preparatívne účely sa nitrácia zvyčajne vykonáva zmesou koncentrovanej kyseliny dusičnej a sírovej, tzv. nitračnej zmesi . V prvej fáze reakcie dochádza k tvorbe nitróniového iónu + NO 2, čo je elektrofilné činidlo:
HO-NO 2 + H 2 SO 4 H 2 O + -NO 2 + HSO 4 -
H20 + -NO2 + H2SO4H30 + + HSO4- + + NIE 2
Prítomnosť nitróniového iónu v tomto roztoku bola potvrdená spektroskopicky. Kyselina dusičná v koncentrovanej kyseline sírovej sa takmer úplne premení na nitróniový katión. Nevýznamná účinnosť samotnej kyseliny dusičnej pri nitračnej reakcii benzénu sa vysvetľuje nízkym obsahom iónu + N02.
Iné systémy sa tiež používajú ako nitračné činidlá, v ktorých sa generuje buď katión + N02 alebo zlúčenina všeobecného vzorca N02-Y, kde Y je dobrá odstupujúca skupina. Niektoré z týchto systémov, ktoré našli najväčšie uplatnenie, sú uvedené v tabuľke 1 v poradí zvyšujúcej sa aktivity.
Tabuľka 1. Nitračné činidlá.
| Nitračné činidlo | Spôsob generovania | Arény podliehajúce nitrácii |
| Kyselina dusičná HO-NO2 |
Fenoly, fenolétery, bifenyl | |
| Acetylnitrát CH3C(O)-O-NO2 | CH3COOH + HNO3 (CH3CO)20 + HNO3 | Benzén, alkylbenzény |
| Oxid dusičitý N204 (0=N-O-N02) |
Benzén, alkylbenzény | |
| Nitračná zmes | H2S04 konc + HNO3 | Benzén, alkylbenzény, halogénbenzény, kyselina benzoová, nitrobenzén, naftalén |
| Chlorid dusnatý Сl-NO 2 |
Benzén, alkylbenzény, nitrobenzén, | |
| Nitroniumtetrafluoroborát BF 4 -+ NO 2 | HF. 2BF3 + HNO3 | dinitrobenzén |
Na príklade nitračnej reakcie alkylbenzénov je jasne viditeľný vplyv priestorových faktorov na smer elektrofilnej substitúcie. Počas nitrácie toluénu (metylbenzénu) orto- izomér vzniká ako hlavný produkt a pri prechode na etyl-, iso-pil- a hlavne aby drhne-butyl-benzén, jeho výťažok výrazne klesá (pozri tabuľku 2).
Tabuľka 2. Vplyv priestorových faktorov na pomer orto-, para-izomérov v nitračnej reakcii (NO 2 +)
Striedanie na pozíciách, % |
|||
C6H5-C2H5 |
|||
C6H5-CH(CH3)2 |
|||
C6H5-C(CH3)3 |
|||
Pri štúdiu nitrácie alkylbenzénov, tzv ipso-substitúcia , keď dôjde k elektrofilnému ataku na atóme uhlíka benzénového kruhu, ktorý už obsahuje substituent, napríklad:

Na rozdiel od nitrácie môže byť počas halogenácie napadnutie aromatického substrátu uskutočnené rôznymi elektrofilmi. Voľné halogény, napríklad Cl2 a Br2 (pozn. 35), môžu ľahko atakovať aktivovaný aromatický kruh (napríklad fenol), ale nie sú schopné reagovať s benzénmi a alkylbenzénmi (fotochemická aktivácia však môže v druhom prípade viesť k výskytu radikálových substitúcií postranných reťazcov, pozri časť IV.3). Na polarizáciu atakujúcej molekuly halogénu je to nevyhnutné Lewisova kyselina katalýza ako je AICI3, FeBr3, atď.; v tomto prípade sa v molekule halogénu objaví takzvaný „elektrofilný koniec“ (energia potrebná na vytvorenie katiónu Hal + je výrazne vyššia). Vďaka tomu je elektrofilná substitúcia oveľa jednoduchšia:

Halogenácia prebieha veľmi energicky, ak sa použijú činidlá, v ktorých má halogén v dôsledku polarizácie silný kladný náboj alebo dokonca existuje ako katión. Áno, veľmi inertný meta-dinitrobenzén možno brómovať brómom v koncentrovanej kyseline sírovej v prítomnosti síranu strieborného. Predpokladá sa, že v tomto prípade sa prechodne vytvorí katión brómu:
2Br2 + Ag2S04 2Br + + 2AgBr + SO42-
Reaktivita elementárneho jódu pri elektrofilných substitučných reakciách v aromatickom kruhu je zanedbateľná, takže priama jodácia je možná len v prípade fenolu a aromatických amínov. Jodácia iných aromatických zlúčenín sa uskutočňuje v prítomnosti oxidačného činidla (zvyčajne kyseliny dusičnej). Predpokladá sa, že za týchto podmienok zohráva úlohu elektrofilného činidla ión I- + OH2.

Môže sa tiež použiť na halogenáciu arénov zmiešané halogény napríklad chlorid brómový (BrCl) alebo jód (ICl):

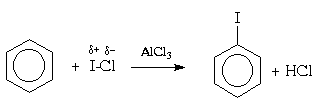
Halogenácia in vivo. Ako príklad elektrofilnej aromatickej halogenácie vyskytujúcej sa v živých organizmoch môžeme uviesť reakciu jodácie aminokyseliny tyrozínu počas biosyntézy hormónov štítnej žľazy obsahujúcich jód na 3-jódtyrozín a potom na 3,5-dijódtyrozín:

Podrobnosti mechanizmu sulfonácie boli študované menej podrobne v porovnaní s nitráciou a halogenáciou. Samotný benzén sa sulfonuje pomerne pomaly horúcou koncentrovanou kyselinou sírovou, ale rýchlo oleom, S03 v inertných rozpúšťadlách alebo komplexom S03 s pyridínom. Povaha elektrofilných druhov závisí od reakčných podmienok, ale pravdepodobne je to vždy SO 3, buď vo voľnom stave, alebo viazaný na „nosič“, napríklad vo forme H 2 SO 4. S03 (H2S207) v kyseline sírovej. Malé množstvá SO 3 sa tvoria v H 2 SO 4:
2H2S04S03 + H30 + + HSO4-
Útok na aromatický substrát vykonáva atóm síry, pretože je silne pozitívne polarizovaný, to znamená, že má nedostatok elektrónov:

Sulfonácia je reverzibilné proces. má praktický význam: pri spracovaní sulfónových kyselín parou sa skupina SO3H nahradí vodíkom. Je teda možné zaviesť skupinu S03H ako substituent, ktorý orientuje následné reakcie požadovaným spôsobom (pozri časť IV.1.B), a potom ju odstrániť. Sulfonácia naftalénu má niektoré zaujímavé vlastnosti (pozri časť IV.1.D).
Podobne ako halogény, aj alkylhalogenidy môžu byť tak vysoko polarizované Lewisove kyseliny(chloridy hliníka a zinku, fluorid boritý atď.), že sa stanú schopnými elektrofilnej substitúcie v aromatickom kruhu:
R-Cl + AlCl 3 R +... Cl ... - AlCl 3 R + AlCl 4 -
Okrem alkylhalogenidov môžu byť zdrojom karbokatiónov na halogenáciu aromatických zlúčenín alkény alebo alkoholy. V tomto prípade je na protonizáciu alkénu alebo alkoholu nevyhnutná prítomnosť protickej kyseliny. V prípade alkoholov je potrebná prísada nie menej ako ekvimolárne množstvo kyseliny (keďže voda uvoľnená počas reakcie deaktivuje ekvimolárne množstvo katalyzátora), zatiaľ čo pri reakciách zahŕňajúcich alkylhalogenidy a alkény stačí pridať malé množstvo katalyzátora.
V laboratóriu má Friedel-Craftsova alkylácia obmedzené použitie, pretože táto reakcia zvyčajne produkuje zmesi produktov z niekoľkých dôvodov:
1) Výsledný alkylačný produkt podlieha elektrofilným aromatickým substitučným reakciám ľahšie ako východisková zlúčenina (Alk je elektrón-donorová skupina), preto sa produkt prednostne alkyluje. Ak chceme získať monoalkylačné produkty, potom je potrebné odobrať veľký nadbytok aromatickej zlúčeniny.
2) Podobne ako sulfonácia, Friedel-Craftsova alkylačná reakcia reverzibilné(pozri tiež časť IV.1.D).
3) Dokonca aj v mierne stavy Primárne a sekundárne alkylhalogenidy poskytujú prednostne sekundárne alebo terciárne alkylarény, pretože k alkylácii dochádza za podmienok približujúcich sa S N 1 reakcie (poznámka 37) Preskupovaniu sa možno vyhnúť, ak pracujete pri nízkych teplotách.
Friedel-Craftsova acylácia aromatických zlúčenín je najdôležitejšou metódou syntézy mastných aromatických ketónov. Deriváty karboxylových kyselín, ako sú acylhalogenidy a anhydridy, majú polárnu karbonylovú skupinu a sú v princípe schopné elektrofilnej substitúcie v aromatických systémoch:

Elektrofilná aktivita týchto zlúčenín je však nízka a musí byť zvýšená pôsobením Lewisových kyselín. V tomto prípade kyslý katalyzátor spravidla napáda atóm kyslíka karbonylovej zlúčeniny a posunutím elektrónovej hustoty zvyšuje kladný náboj susedného atómu uhlíka. V dôsledku toho sa vytvorí polarizovaný komplex (a v limite acylový katión), ktorý pôsobí ako elektrofil:


Dôležitý rozdiel medzi acylačnou reakciou s acylhalogenidmi a alkylačnou reakciou s alkylhalogenidmi je ten, že v prvej z týchto reakcií viac ako 1 mol Lewisovej kyseliny, zatiaľ čo v druhom sú potrebné len katalytické množstvá. Je to spôsobené skutočnosťou, že Lewisova kyselina tvorí komplex ako s acylačným derivátom karboxylovej kyseliny, tak aj s ketónom, reakčným produktom. Pri reakcii s anhydridmi viaže výsledná kyselina ďalší mól katalyzátora, takže celkovo sú potrebné aspoň dva móly. V každom prípade, po dokončení reakcie, musí byť výsledný komplex ketónu s chloridom hlinitým (alebo inou Lewisovou kyselinou) hydrolyticky zničený ( kyselina chlorovodíková s ľadom).
Polyacylácia nie je pozorovaná, pretože výsledný ketón je výrazne menej reaktívny ako materská zlúčenina (pozri časť IV.1.B). Preto je často výhodné získať alkylbenzény nie priamou alkyláciou, ale Friedel-Craftsovou acyláciou, po ktorej nasleduje redukcia. Aromatické zlúčeniny so silne deaktivujúcimi substituentmi, ako sú nitro alebo kyanoskupiny, tiež nie sú Friedel-Crafts acylované.
Kontrolné úlohy
2. Nakreslite diagram potenciálnej energie pre elektrofilnú aromatickú substitučnú reakciu, v ktorej pomalým krokom je tvorba
-komplex (napríklad nitrácia benzénu s nitróniumborofluoridom;
pozri časť IV.1.A).
3. Ktorý produkt vzniká prevažne pri bromácii: a) pár-nitrotoluén; b) meta-nitrobenzénsulfónové kyseliny; V) orto-nitrofenol.
4. Adrenalín (1-(3,4"-dihydroxyfenyl)-2-metylaminoetanol) je prvý hormón izolovaný z drene nadobličiek, v súčasnosti sa syntetizuje v troch fázach z pyrokatecholu. Napíšte rovnicu pre prvý stupeň tejto syntézy - reakciu acylácie pyrokatecholu (1,2-dihydroxybenzénu) s chloridom kyseliny chlóroctovej a vysvetlite mechanizmus).
5. Jednou z kvalitatívnych reakcií na bielkoviny je xantoproteínová reakcia, indikujúca prítomnosť aromatických aminokyselín. Zahŕňa ošetrenie proteínu kyselinou dusičnou pri zahrievaní. Napíšte rovnicu pre xantoproteínovú reakciu s tyrozínom (pozri časť I), ktorá vznikla ako výsledok hydrolýzy proteínu.
Fyzikálne vlastnosti
Benzén a jeho najbližšie homológy sú bezfarebné kvapaliny so špecifickým zápachom. Aromatické uhľovodíky sú ľahšie ako voda a nerozpúšťajú sa v nej, ale sú ľahko rozpustné v organických rozpúšťadlách - alkohol, éter, acetón.
Benzén a jeho homológy sú samy o sebe dobrými rozpúšťadlami pre mnohé organické látky. Všetky arény horia dymovým plameňom kvôli vysokému obsahu uhlíka v ich molekulách.
Fyzikálne vlastnosti niektorých arén sú uvedené v tabuľke.
Tabuľka. Fyzikálne vlastnosti niektorých arén
|
Meno |
Vzorec |
t°.pl., |
t°.b.p., |
|
benzén |
C6H6 |
5,5 |
80,1 |
|
toluén (metylbenzén) |
C6H5CH3 |
95,0 |
110,6 |
|
Etylbenzén |
C6H5C2H5 |
95,0 |
136,2 |
|
Xylén (dimetylbenzén) |
C6H4(CH3)2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
pár- |
13,26 |
138,35 |
|
|
Propylbenzén |
C6H5(CH2)2CH3 |
99,0 |
159,20 |
|
Kumén (izopropylbenzén) |
C6H5CH(CH3)2 |
96,0 |
152,39 |
|
Styrén (vinylbenzén) |
C6H5CH=CH2 |
30,6 |
145,2 |
benzén – nízka teplota varu ( tbalík= 80,1°C), bezfarebná kvapalina, nerozpustná vo vode
Pozor! benzén – jed, pôsobí na obličky, mení zloženie krvi (pri dlhšej expozícii), môže narušiť štruktúru chromozómov.
Väčšina aromatických uhľovodíkov je životu nebezpečná a toxická.
Príprava arénov (benzén a jeho homológy)
V laboratóriu
1. Fúzia solí kyseliny benzoovej s pevnými zásadami
C6H5-COONa + NaOH t → C6H6 + Na2C03
benzoan sodný
2. Wurtz-Fittingova reakcia: (tu G je halogén)
C 6H 5 -G + 2Na + R-G →C 6 H 5 - R + 2 NaG
S 6 H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
V priemysle
- izolované z ropy a uhlia frakčnou destiláciou a reformovaním;
- z uhoľného dechtu a koksárenského plynu
1. Dehydrocyklizácia alkánov s viac ako 6 atómami uhlíka:
C6H14 t , kat->C6H6 + 4H2
2. Trimerizácia acetylénu(iba pre benzén) – r. Zelinského:
3С 2 H 2 600°C, konať. uhlia→C6H6
3. Dehydrogenácia cyklohexán a jeho homológy:
Sovietsky akademik Nikolaj Dmitrievič Zelinskij zistil, že benzén vzniká z cyklohexánu (dehydrogenácia cykloalkánov
C6H12 t, kat->C6H6 + 3H2

C6H11-CH3 t , kat->C6H5-CH3 + 3H2
metylcyklohexán
4. Alkylácia benzénu(príprava benzénových homológov) – r Friedel-Crafts.
C6H6 + C2H5-Cl t, AICI3->C6H5-C2H5 + HCl
chlóretán etylbenzén

Chemické vlastnosti arénov
ja. OXIDAČNÉ REAKCIE
1. Spaľovanie (fajčiarsky plameň):
2C6H6 + 1502 t->12C02 + 6H20 + Q
2. Benzén at normálnych podmienkach neodfarbuje brómovú vodu a vodný roztok manganistanu draselného
3. Benzénové homológy sú oxidované manganistanom draselným (odfarbujú manganistan draselný):
A) v kyslom prostredí na kyselinu benzoovú
Keď sú homológy benzénu vystavené manganistanu draselnému a iným silným oxidačným činidlám, bočné reťazce sa oxidujú. Bez ohľadu na to, aký zložitý je reťazec substituenta, je zničený, s výnimkou a-uhlíkového atómu, ktorý je oxidovaný na karboxylovú skupinu.
Homológy benzénu s jedným bočným reťazcom poskytujú kyselinu benzoovú:
Homológy obsahujúce dva bočné reťazce poskytujú dvojsýtne kyseliny:
5C6H5-C2H5 + 12KMnO4 + 18H2S04 → 5C6H5COOH + 5CO2 + 6K2S04 + 12MnS04 +28H20
5C6H5-CH3 + 6KMnO4 + 9H2S04 → 5C6H5COOH + 3K2S04 + 6MnS04 + 14H20
Zjednodušené :
C6H5-CH3+30 KMnO4→C6H5COOH + H20
B) v neutrálnych a mierne alkalických soliach kyseliny benzoovej
C6H5-CH3 + 2KMnO4 → C6H5COO K + KOH + 2Mn02 + H20
II. PRIDACIE REAKCIE (tvrdšie ako alkény)
1. Halogenácia
C6H6+3CI2 h ν → C6H6CI6 (hexachlórcyklohexán - hexachlóran)
2. Hydrogenácia
C6H6 + 3H2 t , PtaleboNi→C6H12 (cyklohexán)
3. Polymerizácia
III. SUBSTITUČNÉ REAKCIE - iónový mechanizmus (ľahší ako alkány)
1. Halogenácia -
a ) benzén
C6H6+Cl2 AlCl 3 → C6H5-Cl + HCl (chlórbenzén)
C6H6 + 6CI2 t,AlCl3->C6CI6 + 6HCl( hexachlórbenzén)
C6H6 + Br2 t,FeCl3→ C6H5-Br + HBr( brómbenzén)
b) benzénové homológy po ožiarení alebo zahrievaní
Autor: chemické vlastnosti alkylové radikály sú podobné alkánom. Atómy vodíka v nich sú nahradené halogénom mechanizmom voľných radikálov. Preto v neprítomnosti katalyzátora pri zahrievaní alebo UV ožiarení dochádza v postrannom reťazci k radikálovej substitučnej reakcii. Vplyv benzénového kruhu na alkylové substituenty vedie k tomu, že Atóm vodíka je vždy nahradený na atóme uhlíka priamo viazanom na benzénový kruh (a-atóm uhlíka).
1) C6H5-CH3 + Cl2 h ν → C6H5-CH2-Cl + HCl
c) homológy benzénu v prítomnosti katalyzátora
C6H5-CH3 + Cl2 AlCl 3 → (orta zmes, pár derivátov) +HCl
2. Nitrácia (kyselinou dusičnou)
C6H6 + HO-N02 t, H2S04->C6H5-N02 + H20
nitrobenzén - vôňa mandle!
C6H5-CH3 + 3HO-N02 t, H2S04→ S H3-C6H2(N02)3 + 3H202,4,6-trinitrotoluén (tol, TNT)
Aplikácia benzénu a jeho homológov
benzén C6H6 je dobré rozpúšťadlo. Benzén ako prísada zlepšuje kvalitu motorového paliva. Slúži ako surovina na výrobu mnohých aromatických organických zlúčenín - nitrobenzén C 6 H 5 NO 2 (rozpúšťadlo, z ktorého sa získava anilín), chlórbenzén C 6 H 5 Cl, fenol C 6 H 5 OH, styrén atď.
toluén C 6 H 5 –CH 3 – rozpúšťadlo, používané pri výrobe farbív, liečiv a výbušnín (TNT (TNT), alebo 2,4,6-trinitrotoluén TNT).
xylény C6H4(CH3)2. Technický xylén je zmesou troch izomérov ( orto-, meta- A pár-xylény) – používa sa ako rozpúšťadlo a východiskový produkt pri syntéze mnohých organických zlúčenín.
izopropylbenzén C6H5-CH(CH3)2 sa používa na výrobu fenolu a acetónu.
Chlórované deriváty benzénu používa sa na ochranu rastlín. Produktom nahradenia atómov H v benzéne atómami chlóru je teda hexachlórbenzén C 6 Cl 6 - fungicíd; používa sa na suché ošetrenie semien pšenice a raže proti sneťovitá. Produktom adície chlóru do benzénu je hexachlórcyklohexán (hexachlóran) C 6 H 6 Cl 6 - insekticíd; používa sa na boj škodlivého hmyzu. Uvedené látky sú klasifikované ako pesticídy - chemikálie boj proti mikroorganizmom, rastlinám a živočíchom.
styrén C 6 H 5 – CH = CH 2 veľmi ľahko polymerizuje, pričom vzniká polystyrén a pri kopolymerizácii s butadiénom styrén-butadiénové kaučuky.
VIDEO ZÁŽITKY
Existencia -komplexov ako stabilných medziproduktov bola dokázaná priamymi experimentmi. To nevyhnutne neznamená, že prechodný stav elektrofilnej adično-eliminačnej reakcie je podobný štruktúre ako komplexu. V skutočnosti je úloha komplexov v týchto reakciách stále predmetom diskusie. Táto časť sa zameria na mechanizmus aromatickej nitrácie, ktorý vzbudil veľký záujem. Potom sa zvážia ďalšie elektrofilné adično-eliminačné reakcie uvedené vyššie.
Výsledky všetkých kinetických, spektroskopických a kryoskopických prác publikovaných pred rokom 1960 podporujú názor, že nitróniový ión je účinným elektrofilom pri nitračných reakciách arénov. Pomocou spektroskopických a kryoskopických metód boli zistené nízke koncentrácie nitróniového iónu v bezvodej kyseline dusičnej. Je tiež spoľahlivo preukázané, že v prítomnosti veľkého nadbytku kyseliny sírovej sa kyselina dusičná úplne premení na hydrogensíran nitrónium. K nitrácii aromatických zlúčenín, podobnej reaktivite ako benzén, však dochádza v prítomnosti takého množstva vody, že nitróniové ióny nemožno detegovať. Súčasne je tiež prísne preukázaná účasť nitróniových iónov na nitrácii porovnaním rýchlosti nitrácie s rýchlosťou výmeny 180 medzi médiom a kyselinou dusičnou. Nitračné reakcie niektorých reaktívnych substrátov v prítomnosti vody majú nulový kinetický poriadok. To naznačuje, že nitračné činidlo sa tvorí z kyseliny dusičnej v pomalom (obmedzujúcom) štádiu, ktoré predchádza napadnutiu elektrofilu aromatickým kruhom. V neprítomnosti aromatického substrátu je rýchlosť výmeny 180 medzi vodou a kyselinou dusičnou nultého rádu, ako pri nitrácii. Tieto výsledky sú najlepšie vysvetlené nasledujúci diagram(Rovnica 28):
Izolácia nitróniových solí obsahujúcich chloristanové, tetrafluórboritanové a hexafluórfosfátové anióny a skutočnosť, že tieto soli sú účinnými nitračnými činidlami, tiež podporuje vyššie uvedené závery.
Na stanovenie relatívnej reaktivity sa použila nitrácia veľké množstvo aromatické zlúčeniny. Pre veľký počet monosubstituovaných benzénov boli vypočítané relatívne rýchlosti substitúcie v polohách a a so štatistickými korekciami, takzvané faktory parciálnej rýchlosti. Výpočty sa uskutočnili na základe relatívnych rýchlostí s použitím kinetických údajov alebo metódou kompetitívnych reakcií stanovením izomérneho zloženia reakčného produktu za rovnakých experimentálnych podmienok. Veľmi podobné výsledky boli získané nitráciou ekvimolárnych zmesí benzénu a toluénu kyselinou dusičnou v nitrometáne, acetonitrile, acetanhydride alebo kyslých rozpúšťadlách. Tieto výsledky tiež potvrdzujú univerzálnu povahu mechanizmu zahŕňajúceho nitróniový katión. V tabuľke 2.5.2 ukazuje typické príklady. Je zrejmé, že hoci je distribúcia izomérov v reakciách s vopred pripravenými nitróniovými soľami blízka skôr získaným výsledkom, relatívne rýchlosti v reakciách so soľami sú oveľa bližšie k sebe, a preto je koeficient parciálnej rýchlosti, napríklad pre meta -pozičný útok, je zjavne menší ako u jednotlivých benzénových pozícií.
Tabuľka 2.5.2. Faktory orientácie, relatívnej reaktivity a parciálnej rýchlosti pri nitrácii niektorých typických molekúl

Nižšie je uvedená metóda výpočtu s použitím príkladu nitrácie toluénu v porovnaní s benzénom v kyseline octovej pri . Pripomeňme, že benzén má šesť ekvivalentných polôh a toluén má jednu para polohu a dve orto a meta polohy:

Štúdium nitrácie zmesí benzénu s toluénom pomocou vopred pripravených solí nitrónia (pozri tabuľku 2.5.2) a podobné experimenty s m-xylénom a mezitylénom, ktorých relatívna reaktivita v porovnaní s benzénom bola 1,7 a 2,7. , zvýšil počet nejasných otázok. Už vyššie bolo spomenuté o nepochopiteľných výsledkoch získaných pri výpočte čiastkového faktora rýchlosti pre meta polohu. Okrem toho sa zistilo, že v prípade, keď má reakcia čas na to, aby prebehla hlavne predtým, ako reaktanty vytvoria dostatočne homogénnu zmes, výsledky stanovenia reaktivity z kompetitívnych experimentov s vytesňovaním môžu byť chybné.
Je zrejmé, že táto anomálna reaktivita nie je potvrdená pri určovaní rýchlostných konštánt nitrácie soľami nitrónia pomocou kinetických metód. Boli však urobené pokusy zabezpečiť dostatočné premiešanie reaktantov uskutočňovaním reakcie pri rôznych koncentráciách. Tieto výsledky viedli k predpokladu, že rýchlosť množstva reakcií arénov s elektrofilmi, vrátane rýchlosti nitrácie nitróniovými soľami, súvisí skôr s -zásaditosťou ako -zásaditosťou arénov. Inými slovami, tvorba β-komplexu je limitujúcim štádiom. Umiestnenie elektrofilu je však riadené -zásaditosťou, ako ukazujú dostupné údaje o distribúcii izomérov. Tento pohľad na aromatickú nitráciu bol opäť podrobne preskúmaný. Zistilo sa, že korelácia medzi pomerom produktov nitrácie s nitróniovými soľami a relatívnou stabilitou protónovaných metylbenzénov nie je zjavne horšia ako korelácia so stabilitou -komplexov. Pomer produktov kompetitívnej nitrácie polymetylbenzénov zmesou kyselín v sulfoláne tiež slabo koreluje so stabilitou -komplexov.
Problematika stupňa reakcie pri miešaní reagencií bola študovaná na príklade nitrácie bibenzylu, v ktorej je každý kruh reaktivitou podobný toluénu, a navyše prenos vplyvu substituenta medzi kruhmi je minimálny. Keď sa použijú ekvimolárne koncentrácie bibenzylu a nitróniovej soli a činidlá sa úplne zmiešajú pred začatím reakcie, mali by sa vytvoriť mononitrobibenzyl (50 %) a dinitrobibenzyl. Na druhej strane, ak sa reaktanty pred reakciou úplne nezmiešajú, množstvo nezreagovaného substrátu a dinitrobibenzylu by sa malo zvýšiť a množstvo mononitrobibenzylu by sa malo znížiť. Táto myšlienka je však príliš zjednodušená, čo jasne vyplýva z výsledkov nitrácie bibenzylu kyselinou dusičnou v acetanhydride. Úplnosť premiešania nie je pre tento systém dôležitá, ale množstvo dinitrobibeisilu je len 55 % očakávaného množstva. Pri nitrácii bibenzylu v sulfoláne nitróniumtetrafluórborátom s použitím rôznych koncentrácií a podmienok miešania bolo množstvo disubstituovaného produktu vždy výrazne vyššie ako množstvo získané z vyššie uvedeného výpočtu. Jednoduchá metóda kompetitívnych reakcií teda nie je vhodná na stanovenie relatívnej reaktivity aromatických zlúčenín pri nitrácii soľami nitrónia. Je zrejmé, že hlavný vplyv má rýchlosť miešania.
Zaujímavé výsledky sa získali aj pri štúdiu kinetiky nitrácie arénov, ktorých reaktivita je vyššia ako u benzénu a toluénu.
Dalo by sa očakávať, že reaktivita -xylénu, -xylénu a mezitylénu je výrazne väčšia ako reaktivita benzénu (faktory okolo a ), avšak pri zvažovaní výsledkov nitrácie vo vodnej kyseline sírovej (68,3 %) sa ukazuje, že tento faktor je obmedzená na hodnotu 40. Predpokladá sa, že krokom obmedzujúcim rýchlosť v týchto reakciách je vytvorenie zrážkového páru medzi nitróniovým iónom a aromatickým substrátom. Aký je rozdiel medzi týmto predpokladom a predpokladom formácie obmedzujúcej rýchlosť? Už skôr bolo uvedené, že pomer produktov nekoreluje dobre so stabilitou β-komplexov. Tieto fakty možno vysvetliť bez toho, aby sme sa uchýlili k atraktívnym interakciám v rámci „kolízneho páru“. Energetická bariéra pre disociáciu „kolízneho páru“ na zložky môže byť vyššia v kyslom prostredí, táto energia je úplne dostatočná na selektívnu tvorbu komplexu. Keďže kinetické údaje sú v súlade s difúznou teóriou zrážok, mal by sa uprednostniť výraz „kolízny pár“. Diskusia o všetkých vyššie uvedených údajoch vedie k záveru, že schéma rovníc (28) by mala byť upravená tak, ako je to znázornené v rovnici (29), ktorá určuje rýchlosť len za výnimočných okolností. Rôzne konštanty rýchlosti ataku v orto-, meta- alebo para-polohách naznačujú, že distribúcia izomérov nezávisí od limitujúceho štádia, pretože „kolízny pár“ zahŕňa celú molekulu arénu a nie jej jednotlivé atómy.

Diskusia o nitrácii sa dá vhodne zhrnúť z hľadiska energetických profilov, ako je znázornené na obr. 2.5.1. Experimentálne výsledky ukazujú, že v prípade nitrácie benzénu a toluénu je fázou určujúcou rýchlosť tvorba -komplexu (obr. a, resp. b) a tvorba „kolízneho páru“ určuje rýchlosť nitrácie. pseudokuménu (-trimetylbenzén) (obr. c).
Distribúcia izomérov, ktorá bola objavená pri nitrácii toluénu (pozri tabuľku 2.5.2.), je v zásade nezávislá od reakčných podmienok, s výnimkou obvyklého vplyvu teploty. Nezvyčajné výsledky získané štúdiom niektorých polymetylbenzénov však komplikujú pochopenie nitračnej reakcie. Nitrácia kyselinou dusičnou v acetanhydride teda vedie k acetoxylačným produktom. Toto zmiešava veci, čo naznačuje, že prebieha elektrofilná acetoxylácia. V súčasnosti nie je známe, že by to tak bolo.


Ryža. 2.5.1. Energetické profily pre nitračné reakcie benzénu (a) a toluénu (b) a tvorbu 5- a : a, b-limitujúcim stupňom je tvorba -komplexu; c - limitujúcim štádiom je vytvorenie kolízneho páru.
Hoci je kyselina dusičná prítomná hlavne vo forme acetylnitrátu, stále existujú určité pochybnosti o skutočnej povahe elektrofilu. Kyselina dusičná v acetanhydride teda reaguje s -xylénom za vzniku zmesi -dimetylnitrobenzénu a -dimetylfenylacetátu. Izolácia aduktov, v ktorých sa acetylnitrát pridáva v substituovanej polohe (ipso-útok), a skutočnosť, že tieto adukty sa zjavne rozkladajú intramolekulárnym mechanizmom za vzniku acetátu (57), hovoria v prospech mechanizmu znázorneného v schéme rovnice (30):

Podobné adukty (58)-(64) boli izolované v reakciách s inými arénmi a niektoré adukty boli nájdené ako medziprodukty. Reakciou kyseliny dusičnej v acetanhydride s n-terc-butyltoluénom pri nízkej teplote sa získali a izolovali tri adukty. Hlavným produktom je adukt (64), ktorý sa zjavne tvorí v viac než ostatné dva izoméry v dôsledku stérickej zábrany v polohe 4 (ipso k tert-Vi). Iné nukleofily, ako je dusičnanový ión a voda, sa môžu tiež pridať k ipso-substituovanému a-komplexu. Ipso-substituované β-komplexy sa môžu regenerovať acidolýzou.

Nitráciou o-xylénu v kyseline sírovej vzniká -dimetylnitrobenzén a -dimetylnitrobenzén, ktorých výťažok závisí od kyslosti systému. Pri nízkej kyslosti sa získavajú aj nitrodimetylfenoly. Acidolýzou esterov (58) a (59) vzniká -dimetylnitrobenzén, ktorého výťažok sa zvyšuje so zvyšujúcou sa kyslosťou; to podporuje názor, že nitrácia orto polohy na alkylovú skupinu pravdepodobne často zahŕňa počiatočný ipso útok. Skutočnosť, že acidolýza (58) a (59) neprodukuje -dimetylnitrobenzén znamená, že pôvodný ipso-substituovaný o-komplex sa netransformuje späť na „kolízny pár“ a že nedochádza ani k α, ani k následným β-posunom nitroskupiny. v ňom. Tieto výsledky sú zhrnuté v rovniciach (31). Nárast výťažku a so zvyšujúcou sa kyslosťou média počas nitrácie -trimetylbenzénu v kyseline sírovej sa pripisuje migrácii nitroskupiny z do resp.

V súčasnosti nie je známy jediný spoľahlivý príklad sekvenčných intramolekulárnych posunov cez nesubstituovanú polohu. Sú však známe po sebe nasledujúce -posuny z jednej ipso-pozície cez inú ipso-pozíciu. Napríklad acidolýza (65) produkuje štruktúrne izoméry (66) a (67), ako je znázornené v rovnici (32).

Predtým sa spomínala eliminácia ipso substituentu, napríklad v prípade protodesilylácie a protodesulfurizácie (pozri str. 330, 331). Z tohto hľadiska budeme diskutovať len o nahradení ipso substituentu nitroskupinou. Mnohé reakcie tohto typu sú známe už dlho, ale ich mechanizmus spravidla nie je jasný. Takéto reakcie zahŕňajú dealkyláciu, deacyláciu, desilyláciu, desulfonáciu, dekarboxyláciu, dediazotáciu a dehalogenáciu. Reakcie zahŕňajúce substráty, ktoré sú vysoko aktivované smerom k elektrofilnému útoku, môžu zahŕňať počiatočnú nitrozáciu, po ktorej nasleduje oxidácia.




